基因敲除RAW 264.7细胞:炎症与免疫研究的重要工具
RAW 264.7是一种小鼠单核巨噬细胞系,广泛应用于免疫学、炎症反应及信号通路研究。该细胞具有典型的巨噬细胞特性,如吞噬能力、细胞因子分泌及模式识别受体(PRRs)表达,使其成为研究先天免疫的重要模型。基因敲除(KO)技术(如CRISPR-Cas9)可在RAW 264.7细胞中精准删除特定基因,以探究该基因在炎症、感染或肿瘤微环境中的作用。例如,敲除NF-κB或NLRP3等关键基因可揭示其在免疫调控中的分子机制,为疾病治疗提供新靶点。
基因敲除RAW 264.7细胞的应用潜力
- 炎症性疾病研究:如敲除TNF-α或IL-6基因,可解析其在类风湿性关节炎或脓毒症中的作用。
- 感染免疫机制:敲除TLR4或MyD88可研究细菌脂多糖(LPS)诱导的免疫应答。
- 肿瘤相关巨噬细胞(TAM)调控:敲除STAT3或CSF1R可探索巨噬细胞极化对肿瘤进展的影响。
- 药物靶点验证:通过基因敲除筛选关键信号分子,助力抗炎或抗癌药物开发。
基因敲除RAW 264.7细胞研究案例介绍
案例一:敲除 NLRP3 研究炎症小体激活机制- 研究背景:NLRP3炎症小体是先天免疫的核心组分,其过度激活与痛风、阿尔茨海默病等疾病相关。
- 实验设计:研究者利用CRISPR-Cas9敲除RAW 264.7细胞的NLRP3基因,并用LPS+ATP刺激,检测IL-1β分泌。
- 结果:KO细胞中IL-1β释放显著降低,证实NLRP3是炎症小体激活的关键分子(参考文献:Nature Immunology, 2020)。
案例二:敲除 IRF5 调控巨噬细胞极化
- 研究背景:IRF5驱动巨噬细胞向促炎(M1)表型极化,影响自身免疫疾病进程。
- 实验设计:在RAW 264.7中敲除IRF5,通过流式细胞术检测M1标志物(CD86、iNOS)表达。
- 结果:IRF5-KO细胞M1极化减弱,提示其可作为自身免疫疾病的治疗靶点(参考文献:Cell Reports, 2021)。
基因敲除RAW 264.7细胞为免疫和炎症研究提供了高效、可定制的模型,结合CRISPR等基因编辑技术,将持续推动疾病机制解析和精准治疗策略的开发。
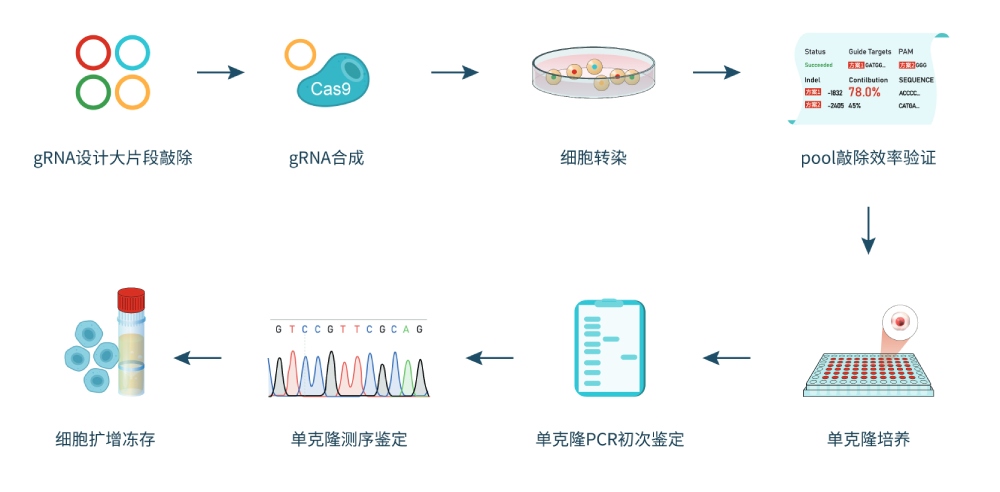
微谨生物敲除细胞构建流程
