基因敲除MC-3T3细胞:骨生物学与骨质疏松研究的关键模型
MC-3T3-E1(简称MC-3T3)是一种小鼠前成骨细胞系,广泛用于骨形成、矿化及骨相关疾病的研究。该细胞具有分化为成熟成骨细胞的潜能,在体外可模拟骨基质沉积、钙化及成骨相关基因(如Runx2、Osterix和ALP)的表达调控。基因敲除技术(如CRISPR-Cas9)可在MC-3T3细胞中靶向删除特定基因,以研究其在骨代谢、骨再生或骨质疏松中的作用。例如,敲除BMP2或Wnt/β-catenin通路基因可揭示其对成骨分化的影响,为骨修复和抗骨质疏松药物开发提供理论依据。
基因敲除MC-3T3细胞的应用潜力
- 成骨分化机制研究:敲除Runx2或Osterix可探究其对骨形成的关键调控作用。
- 骨质疏松与骨代谢疾病:敲除RANKL或OPG可研究破骨细胞-成骨细胞偶联机制。
- 骨再生与组织工程:敲除BMPs或TGF-β家族基因可优化骨支架材料的生物相容性。
- 药物筛选与靶点验证:通过基因敲除筛选影响骨形成的信号分子,助力抗骨质疏松药物研发。
基因敲除MC-3T3细胞研究案例介绍
案例一:敲除 Runx2 揭示其在成骨分化中的核心作用
- 研究背景:Runx2是成骨细胞分化的主调控因子,其突变可导致颅骨发育异常(如锁骨颅骨发育不全)。
- 实验设计:研究者利用CRISPR-Cas9敲除MC-3T3细胞的Runx2基因,并通过碱性磷酸酶(ALP)染色和Alizarin Red S(ARS)矿化实验评估成骨能力。
- 结果:Runx2-KO细胞的ALP活性和钙结节形成显著减少,证实Runx2是成骨分化的必需基因(参考文献:Journal of Bone and Mineral Research, 2019)。
案例二:敲除 SOST 促进骨形成并抑制骨吸收
- 研究背景:SOST基因编码硬化蛋白(Sclerostin),是Wnt信号通路的负调控因子,其抑制可增强骨密度。
- 实验设计:在MC-3T3细胞中敲除SOST,检测成骨标志物(如OCN、COL1A1)表达及体外矿化能力。
- 结果:SOST-KO细胞表现出更强的成骨活性和矿化能力,提示靶向SOST可能成为治疗骨质疏松的新策略(参考文献:Nature Communications, 2021)。
基因敲除MC-3T3细胞为骨生物学研究提供了强大的工具,结合基因编辑技术,可深入解析骨形成机制、开发骨相关疾病的新型疗法,并推动骨组织工程的应用进展。
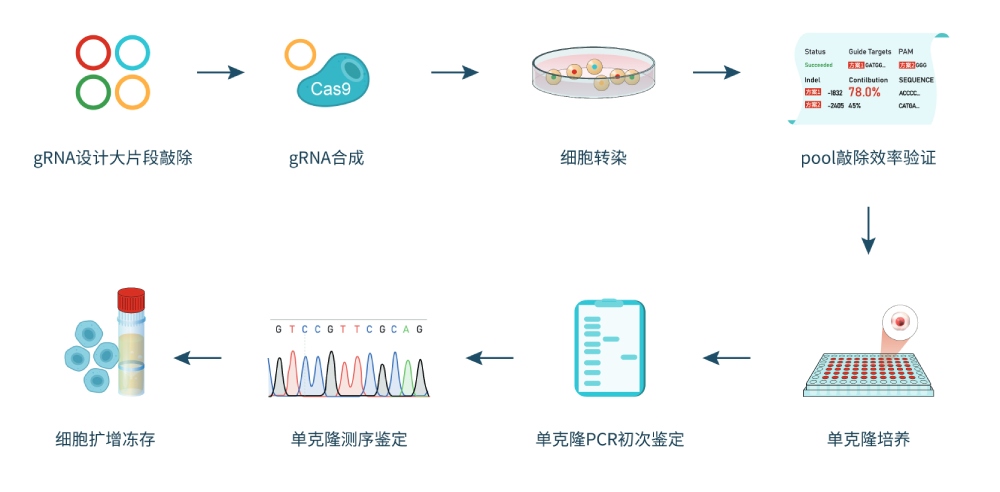
微谨生物敲除细胞构建流程
