基因敲除HeLa细胞:癌症研究与细胞生物学的重要平台
HeLa细胞是人类宫颈癌细胞系,自1951年分离以来已成为生物医学研究中最广泛使用的永生化细胞系。该细胞具有快速增殖、易于培养和遗传稳定性等特点,使其成为癌症生物学、病毒感染、药物筛选等研究的黄金标准模型。通过CRISPR-Cas9等基因编辑技术对HeLa细胞进行基因敲除(KO),可以精确研究特定基因在肿瘤发生、转移和治疗抵抗中的作用。例如,敲除TP53或EGFR等关键基因,可揭示其在细胞周期调控或靶向治疗响应中的分子机制。
基因敲除HeLa细胞的应用潜力
- 癌症机制研究:敲除致癌基因(如MYC)或抑癌基因(如PTEN)可解析其在肿瘤发生发展中的作用
- 药物靶点验证:通过敲除药物靶点基因(如PARP1)评估其对化疗敏感性的影响
- 病毒感染研究:敲除宿主因子(如ACE2)研究病毒入侵机制
- 细胞凋亡与自噬:敲除BAX/BAK或ATG基因研究程序性细胞死亡通路
- 基因组稳定性:敲除DNA修复基因(如BRCA1)研究基因组维护机制
基因敲除HeLa细胞研究案例介绍
案例一:敲除HPV E6/E7基因研究宫颈癌发生机制
- 研究背景:HeLa细胞含有HPV18的E6/E7癌基因,是维持其恶性表型的关键因素。
- 实验设计:研究者利用CRISPR-Cas9敲除HeLa细胞中的E6/E7基因,通过CCK-8检测细胞增殖,流式细胞术分析细胞周期。
- 结果:E6/E7-KO细胞增殖显著减慢,G1期阻滞,证实HPV癌基因是HeLa细胞恶性生长的驱动因素(参考文献:Oncogene, 2020)。
案例二:敲除PD-L1增强免疫治疗效果
- 研究背景:PD-L1是肿瘤免疫逃逸的关键检查点分子。
- 实验设计:在HeLa细胞中敲除PD-L1基因,与T细胞共培养后检测肿瘤细胞杀伤效率。
- 结果:PD-L1-KO细胞对T细胞介导的杀伤更敏感,为联合免疫治疗提供新思路(参考文献:Cancer Research, 2021)。
基因敲除HeLa细胞作为经典的研究模型,持续为癌症生物学、药物开发和基础细胞研究提供重要见解。结合新型基因编辑技术和多组学方法,将进一步推动精准医学和转化研究的发展。
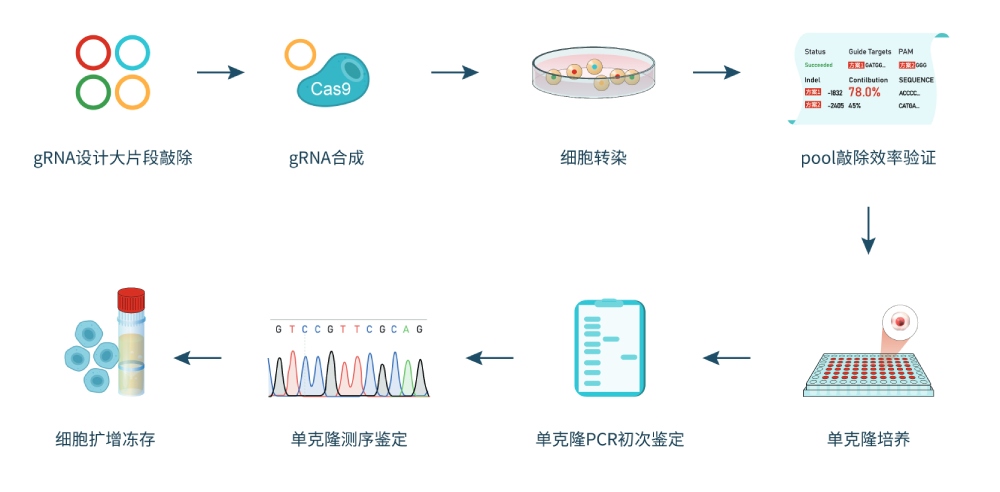
微谨生物敲除细胞构建流程
