基因敲除ARPE-19细胞:视网膜疾病研究的理想模型
ARPE-19是一种人类视网膜色素上皮(RPE)细胞系,被广泛用于眼科疾病和视觉科学研究。作为视网膜外层的重要组成部分,RPE细胞在维持光感受器功能、血-视网膜屏障形成以及视觉循环中发挥关键作用。通过CRISPR-Cas9等基因编辑技术对ARPE-19细胞进行基因敲除(KO),可以精确研究特定基因在视网膜退行性疾病、代谢异常和氧化应激反应中的作用。例如,敲除RPE65或ABCA4等视觉循环关键基因,可模拟遗传性视网膜病变的病理过程,为疾病机制研究和治疗开发提供重要平台。
基因敲除ARPE-19细胞的应用潜力
- 年龄相关性黄斑变性(AMD)研究:敲补体因子基因(如CFH)或炎症相关基因(如IL-6)研究其对视网膜损伤的影响
- 遗传性视网膜疾病:敲除RPE65或MERTK模拟视网膜色素变性等遗传疾病
- 氧化应激与光损伤:敲除抗氧化基因(如SOD2)研究RPE细胞光保护机制
- 药物筛选平台:通过建立特定基因敲除细胞系评估视网膜保护药物的效果
- 细胞治疗研究:利用基因编辑优化RPE细胞移植治疗方案
基因敲除ARPE-19细胞研究案例介绍
案例一:敲除RPE65研究莱伯先天性黑朦(LCA)
- 研究背景:RPE65基因突变导致视觉循环障碍,是LCA2型的主要病因。
- 实验设计:研究者利用CRISPR-Cas9构建RPE65-KO的ARPE-19细胞系,通过高效液相色谱(HPLC)分析视黄醛代谢产物。
- 结果:RPE65缺失导致全反式视黄酯积累,11-顺式视黄醛生成障碍,成功模拟LCA病理特征(参考文献:PNAS, 2019)。
案例二:敲除CFH研究AMD发病机制
- 研究背景:补体因子H(CFH)基因多态性与AMD风险显著相关。
- 实验设计:在ARPE-19细胞中敲除CFH基因,通过ELISA检测补体活化产物(C3a,C5a),并评估氧化应激标志物。
- 结果:CFH缺失导致补体系统过度活化,加剧氧化应激诱导的RPE细胞损伤(参考文献:Nature Medicine, 2020)。
基因敲除ARPE-19细胞为视网膜疾病研究提供了高度相关的体外模型,特别是在模拟遗传性眼病和AMD病理机制方面具有独特优势。随着基因编辑技术的进步和视网膜类器官的发展,该模型将继续推动眼科疾病机制解析和创新疗法的开发。
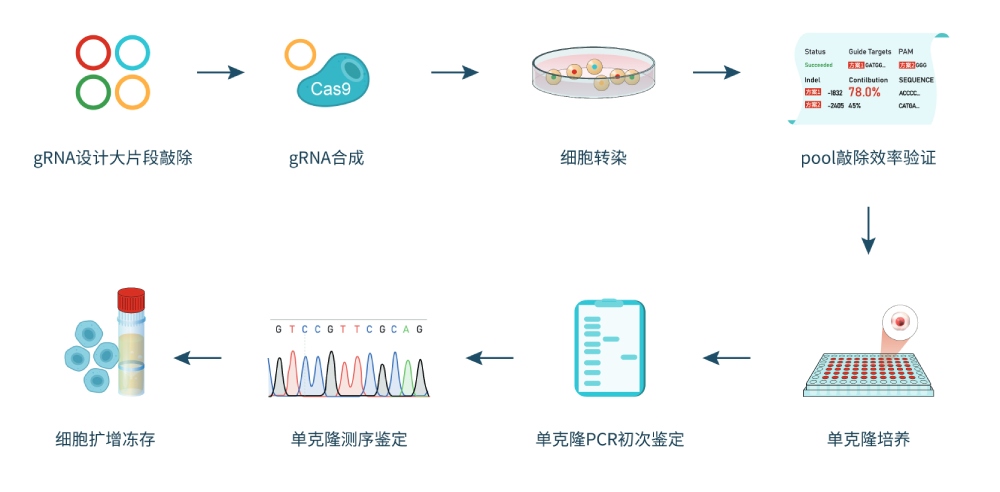
微谨生物敲除细胞构建流程
