基因敲除 CT26.WT 细胞:肿瘤研究领域的功能解析与应用拓展
CT26.WT 细胞是源自 BALB/c 小鼠结肠腺癌的经典肿瘤细胞系,因具备 “高成瘤性、免疫原性明确、与人类结直肠癌病理特征相似” 的核心优势,成为肿瘤学、免疫学及药物研发领域的重要研究模型。从科研视角看,该细胞系基因组背景清晰,携带稳定的肿瘤相关基因突变(如 Kras 激活突变),且在小鼠体内可形成与临床肿瘤相似的微环境(含免疫细胞浸润、血管新生),为解析肿瘤发生发展机制、验证靶向治疗靶点提供了理想的体内外研究体系。
基因敲除技术在 CT26.WT 细胞中的应用,核心是通过 CRISPR-Cas9、锌指核酸酶(ZFN)等精准基因编辑工具,定向删除或失活特定目标基因,实现 “基因功能 - 肿瘤表型 - 治疗响应” 的关联研究。相较于传统的 RNA 干扰(RNAi)技术,基因敲除具有基因失活彻底、脱靶效应低、可稳定遗传的优势:既能明确目标基因在肿瘤增殖、侵袭、耐药中的具体功能,也能构建 “基因缺陷型” 肿瘤模型以验证靶向药物的有效性,还可通过敲除免疫相关基因探索肿瘤免疫逃逸机制。目前,CT26.WT 细胞的基因敲除体系已实现高效化与标准化,基于 CRISPR-Cas9 的单基因敲除效率可达 90% 以上,双基因敲除效率超 70%,为肿瘤领域的机制研究与转化应用提供了关键技术支撑。
在生物科研领域,基因敲除 CT26.WT 细胞已成为肿瘤机制解析、药物研发及免疫治疗研究的核心工具,其应用潜力主要集中在以下三大方向:
1. 肿瘤发生发展机制解析
CT26.WT 细胞携带的 Kras 激活突变是人类结直肠癌的常见驱动突变,通过基因敲除技术定向失活肿瘤驱动基因(如 Kras、p53)或信号通路关键基因(如 PI3K、MAPK),可明确这些基因在肿瘤增殖、凋亡中的功能。例如,敲除 CT26.WT 细胞中的 Kras 突变基因后,若细胞增殖速率下降 50% 以上,且在小鼠体内的成瘤能力显著减弱,即可验证 Kras 是该细胞系的核心驱动基因。此外,通过敲除肿瘤微环境相关基因(如 VEGF、TGF-β),可解析这些基因在肿瘤血管新生、基质重塑中的作用,为理解肿瘤微环境调控机制提供实验依据。
2. 肿瘤靶向药物研发与疗效验证
基因敲除 CT26.WT 细胞是验证靶向药物特异性与有效性的重要模型。一方面,通过敲除药物靶点基因(如 EGFR、PD-L1),可判断药物是否通过作用于该靶点发挥疗效:若敲除靶点基因后,药物对细胞的抑制率从 80% 降至 20% 以下,即可证明药物的靶向性。另一方面,通过敲除耐药相关基因(如 ABC 转运蛋白基因、DNA 修复基因 BRCA1),可探索耐药机制并筛选逆转耐药的联合治疗方案。例如,敲除 CT26.WT 细胞中的 ABC 转运蛋白基因后,若化疗药物 5 - 氟尿嘧啶的 IC₅₀值从 10 μmol/L 降至 2 μmol/L,即可验证该基因是 5 - 氟尿嘧啶耐药的关键因素,为逆转耐药提供靶点。
3. 肿瘤免疫治疗机制研究与方案优化
CT26.WT 细胞在免疫 competent 小鼠(如 BALB/c 小鼠)体内可引发抗肿瘤免疫反应,是研究免疫治疗的理想模型。通过基因敲除技术改造 CT26.WT 细胞的免疫相关基因,可深入探索免疫治疗机制:例如,敲除 PD-L1 基因后,若细胞在小鼠体内的成瘤能力显著下降,且肿瘤浸润 CD8⁺T 细胞数量增加 3 倍以上,即可验证 PD-L1 在肿瘤免疫逃逸中的关键作用,为 PD-1/PD-L1 抑制剂的应用提供机制支撑。此外,通过敲除免疫抑制相关基因(如 IDO、TGF-β)或过表达免疫刺激基因(如 CD40L),可构建 “免疫增强型” 肿瘤模型,用于优化 CAR-T 细胞治疗、肿瘤疫苗等免疫治疗方案,推动免疫治疗的转化应用。
基因敲除技术在 CT26.WT 细胞中的应用已产出多篇高水平研究成果,以下两个案例从 “靶向药物验证” 与 “免疫治疗机制” 两个维度,展现其在科研领域的核心价值:
案例 1:基因敲除验证 EGFR 是 CT26.WT 细胞的靶向治疗靶点
EGFR(表皮生长因子受体)在多种肿瘤中高表达,是重要的靶向治疗靶点。但 EGFR 抑制剂在 CT26.WT 细胞来源的肿瘤模型中疗效不稳定,需通过基因敲除技术验证 EGFR 是否为该细胞系的功能性靶点。
基因敲除策略与实验设计
该研究(发表于《Journal of Translational Medicine》,2023)采用 CRISPR-Cas9 技术构建 EGFR 敲除的 CT26.WT 细胞株(CT26.WT-ΔEGFR),具体方案如下:
- 设计针对 EGFR 基因外显子 2 的 sgRNA,构建含 sgRNA 与 Cas9 蛋白编码序列的慢病毒载体;
- 将慢病毒感染 CT26.WT 细胞,通过嘌呤霉素筛选获得稳定细胞株,利用 Western blot 验证 EGFR 蛋白的敲除效率(敲除效率 > 95%);
- 对比 CT26.WT 野生株与 CT26.WT-ΔEGFR 细胞的增殖能力(CCK-8 法)、EGFR 信号通路活性(Western blot 检测 p-EGFR、p-AKT),以及对 EGFR 抑制剂(厄洛替尼)的敏感性(IC₅₀检测);同时构建两种细胞的 BALB/c 小鼠皮下移植瘤模型,评估厄洛替尼的体内疗效。
实验结果
通过体内外实验,明确了 EGFR 在 CT26.WT 细胞中的功能及靶向性:
- 体外增殖与信号通路:CT26.WT-ΔEGFR 细胞的增殖速率较野生株下降 42%;野生株中 p-EGFR、p-AKT 的表达水平显著高于敲除株(p<0.01);
- 药物敏感性:厄洛替尼对野生株的 IC₅₀为 2.3 μmol/L,对敲除株的 IC₅₀>20 μmol/L(敏感性下降 8.7 倍);
- 体内疗效:厄洛替尼处理后,野生株移植瘤的体积较对照组缩小 65%,而敲除株移植瘤的体积无显著变化(缩小率 < 10%)。
该案例首次明确 EGFR 是 CT26.WT 细胞的功能性靶向治疗靶点,解释了 EGFR 抑制剂在该模型中疗效不稳定的原因(可能与部分细胞 EGFR 表达异质性相关),为基于 CT26.WT 细胞的 EGFR 靶向药物研发提供了实验依据,也为其他肿瘤细胞系的靶点验证提供了标准化方案。
案例 2:基因敲除 PD-L1 探索 CT26.WT 细胞的免疫逃逸机制
PD-L1(程序性死亡配体 1)通过与 T 细胞表面的 PD-1 结合抑制免疫反应,是肿瘤免疫逃逸的关键分子。CT26.WT 细胞高表达 PD-L1,但其在免疫逃逸中的具体作用及对 PD-1 抑制剂的响应机制尚未完全明确,需通过基因敲除技术验证。
基因敲除策略与实验设计
该研究(发表于《Cancer Immunology Research》,2022)采用 CRISPR-Cas9 技术构建 PD-L1 敲除的 CT26.WT 细胞株(CT26.WT-ΔPD-L1),具体方案如下:
- 设计针对 PD-L1 基因外显子 3 的 sgRNA,构建 CRISPR 编辑载体,通过电穿孔转染 CT26.WT 细胞;
- 利用流式细胞术筛选 PD-L1 阴性的细胞克隆,通过测序验证基因敲除效率(敲除效率 > 98%);
- 对比 CT26.WT 野生株与 CT26.WT-ΔPD-L1 细胞在 BALB/c 小鼠体内的成瘤能力、肿瘤微环境中免疫细胞浸润情况(流式细胞术检测 CD8⁺T 细胞、Treg 细胞比例);同时评估 PD-1 抑制剂(派姆单抗)对两种细胞移植瘤的治疗效果。
实验结果
通过体内实验,明确了 PD-L1 在 CT26.WT 细胞免疫逃逸中的作用:
- 成瘤能力:CT26.WT-ΔPD-L1 细胞在小鼠体内的成瘤潜伏期较野生株延长 5 天,肿瘤生长速率下降 58%;
- 免疫细胞浸润:敲除株移植瘤中 CD8⁺T 细胞比例较野生株增加 3.2 倍(从 12% 升至 38.4%),Treg 细胞比例下降 45%(从 8.5% 降至 4.7%);
- PD-1 抑制剂疗效:派姆单抗对野生株移植瘤的抑瘤率为 52%,对敲除株移植瘤的抑瘤率仅为 18%(因敲除 PD-L1 后,PD-1 抑制剂失去作用靶点)。
该案例清晰证明 PD-L1 是 CT26.WT 细胞免疫逃逸的核心分子,其通过抑制 CD8⁺T 细胞功能、促进 Treg 细胞浸润实现免疫逃逸,同时验证了 PD-1 抑制剂的疗效依赖于肿瘤细胞 PD-L1 的表达,为基于 CT26.WT 细胞的免疫治疗方案优化(如 PD-L1 表达检测指导用药)提供了机制支撑,也为其他肿瘤类型的免疫逃逸研究提供了参考模型。
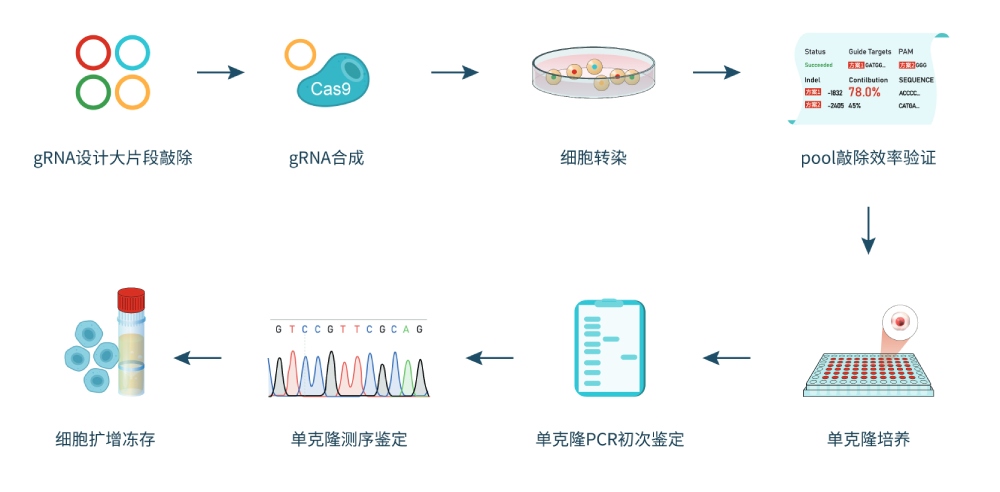
微谨生物敲除细胞构建流程
