基因敲除乳酸菌:科研领域的“精准改造”与应用探索
乳酸菌(Lactic Acid Bacteria, LAB)是一类革兰氏阳性、兼性厌氧的益生菌群,广泛存在于自然界及人和动物肠道中,因能发酵碳水化合物产生乳酸而得名,其基因组多为环状双链 DNA,大小约 1.8-3.3 Mb,包含大量与代谢调控、益生功能、耐药性及环境适应性相关的功能基因。基因敲除技术是基于同源重组、CRISPR-Cas 系统等分子生物学方法,精准删除乳酸菌基因组中特定目标基因的技术手段,核心原理是通过构建含同源臂的敲除载体,介导目标基因与载体片段发生重组交换,从而实现基因的定点缺失。该技术打破了传统诱变育种的随机性,为从分子层面解析乳酸菌基因功能、调控代谢通路提供了 “精准编辑” 工具,是现代微生物分子遗传学研究的核心技术之一。
基因敲除乳酸菌凭借其 “精准改造” 的特性,在生物科研领域展现出多维度应用价值,成为解析微生物功能、开发新型生物技术的重要载体:
- 基因功能验证:通过敲除目标基因(如乳酸脱氢酶基因 ldh、胞外多糖合成基因 eps、益生菌黏附基因 mapA 等),对比敲除菌株与野生型菌株在生长特性、代谢产物、环境适应性等方面的差异,可直接明确该基因的生物学功能,为乳酸菌分子机制研究奠定基础。
- 代谢通路解析与重构:乳酸菌的乳酸发酵、风味物质合成、益生活性物质(如细菌素、短链脂肪酸)产生等过程均由特定代谢通路调控,敲除通路中的关键基因(如分支酸合成酶基因 aroA、乙酸激酶基因 ackA)可阻断冗余支路或强化目标产物合成,助力解析代谢网络的调控逻辑,为代谢工程改造提供靶点。
- 肠道微生物互作研究:作为肠道益生菌的重要成员,乳酸菌与宿主肠道黏膜、其他微生物的互作机制是科研热点。通过敲除乳酸菌的黏附基因(如纤连蛋白结合基因 fnbp)、信号分子合成基因(如群体感应基因 luxS),可探究其在肠道定植、免疫调节、菌群平衡维持中的作用机制,为益生菌制剂的优化提供理论支撑。
- 新型表达载体构建:基因敲除技术可删除乳酸菌中无关的耐药基因、毒力因子基因(若存在),构建安全的 “空载体” 菌株,再通过同源重组插入外源基因(如抗原基因、酶基因),使其成为高效的微生物表达系统,应用于疫苗研发、工业酶生产等领域,具有低成本、高安全性的潜力。
案例一:CRISPR-Cas9 介导的乳酸菌乳酸脱氢酶基因敲除 —— 代谢通路重构研究
乳酸菌发酵产生的乳酸是食品发酵、生物基材料合成的重要原料,但传统菌株存在乳酸产量低、副产物(如乙酸)多的问题。乳酸脱氢酶(LDH)是乳酸合成的关键酶,敲除 ldh 基因可阻断乳酸合成,验证其在代谢通路中的核心作用,同时为重构高产目标产物的工程菌株提供依据。
研究方法与结果:
- 以模式菌株植物乳杆菌(Lactobacillus plantarum)WCFS1为研究对象,构建含 ldh 基因同源臂的 CRISPR-Cas9 敲除载体(载体包含 Cas9 基因、sgRNA 靶向 ldh 基因编码区、氯霉素抗性基因);
- 将载体电转化至植物乳杆菌感受态细胞,通过 Cas9 蛋白介导的 DNA 双链断裂,结合同源重组修复,实现 ldh 基因的定点敲除;
- 对比野生型(WT)与敲除菌株(Δldh)的代谢产物:WT 菌株乳酸产量为 12.3 g/L,乙酸产量 1.8 g/L;Δldh 菌株乳酸产量降至 0.5 g/L,乙酸产量提升至 4.2 g/L,同时乙醇产量增加 3 倍,证实 ldh 基因是乳酸合成的必需基因,且阻断乳酸支路后,代谢流转向乙酸和乙醇合成通路。
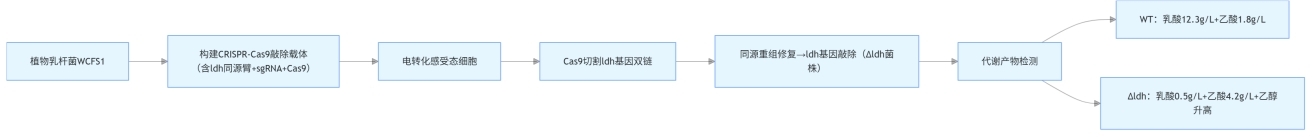
该案例首次利用 CRISPR-Cas9 技术实现植物乳杆菌 ldh 基因的高效敲除,不仅明确了 LDH 在乳酸合成中的不可替代作用,还为通过基因编辑重构乳酸菌代谢通路、优化产物合成提供了成熟技术方案,后续可通过导入高活性 ldh 突变基因,构建高产乳酸的工程菌株。
案例二:乳酸菌黏附基因 mapA 敲除 —— 肠道定植机制研究
研究背景:乳酸菌在肠道内的定植能力是其发挥益生作用的前提,黏附基因 mapA 编码的黏附蛋白可介导乳酸菌与宿主肠道上皮细胞的结合,但其在定植过程中的具体作用尚未完全明确,需通过基因敲除验证。
研究方法与结果:
- 选取肠道益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus)GG为研究对象,采用同源重组法构建 mapA 基因敲除载体(同源臂长度 500 bp,含红霉素抗性基因);
- 通过接合转移将载体导入鼠李糖乳杆菌 GG,筛选获得 mapA 敲除菌株(ΔmapA);
- 体外肠道上皮细胞(Caco-2 细胞)黏附实验:WT 菌株黏附率为 23.5%,ΔmapA 菌株黏附率降至 4.8%,显著低于 WT;
- 体内定植实验:给小鼠灌胃 WT 和 ΔmapA 菌株,7 天后检测肠道菌群,WT 菌株在盲肠、结肠的定植量分别为 10⁷ CFU/g、10⁶ CFU/g,而 ΔmapA 菌株定植量仅为 10⁴ CFU/g、10³ CFU/g,且 3 天后即难以检测到。
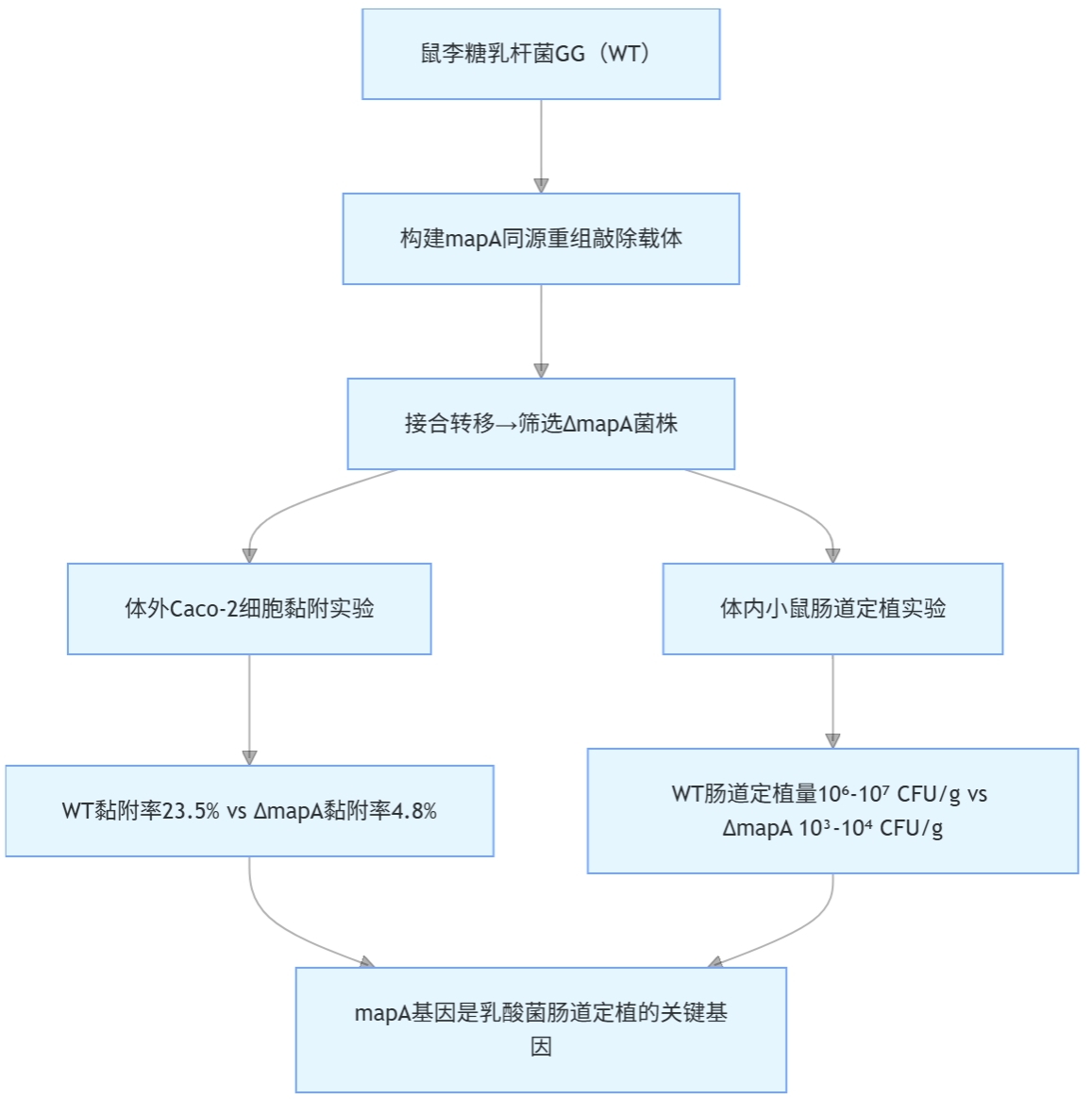
该研究通过基因敲除直接证实 mapA 基因编码的黏附蛋白是乳酸菌肠道定植的核心因子,为解析乳酸菌 - 宿主肠道的互作机制提供了关键证据,同时为益生菌制剂的改良指明方向 —— 通过强化 mapA 基因表达,可提升乳酸菌的肠道定植能力,增强益生效果。
